|
|||
|
|||
Στρες, Κατάθλιψη και Alzheimer: Το τρίγωνο της λήθης;
Δ. ΦΩΣΚΟΛΟΣ*
*Ειδικευόμενος Ψυχίατρος, Υποψήφιος Διδάκτωρ, Β΄ Νευρολογική Κλινική ΑΧΕΠΑ, Θεσσαλονίκη
Η παρούσα εργασία παρουσιάστηκε ως ελεύθερη ανακοίνωση κατά τη διάρκεια στρογγυλής τράπεζας με τίτλο “Νευροχημεία και άνοια” στα πλαίσια του 7ου Πανελλήνιου Διεπιστημονικού Συνεδρίου Νόσου Alzheimer & Συγγενών Διαταραχών, που έλαβε χώρα στη Θεσσαλονίκη από τις 16 έως τις 20 Φεβρουαρίου 2011.
Περίληψη
Η νόσος του Alzheimer αποτελεί τη συχνότερη αιτία νευροεκφύλισης και άνοιας στον ηλικιωμένο πληθυσμό και χαρακτηρίζεται από προοδευτική έκπτωση των γνωστικών λειτουργιών με παράλληλη εκδήλωση ψυχιατρικών συμπτωμάτων όπως η ψύχωση και η κατάθλιψη.
Η κατάθλιψη αποτελεί μια συχνότατη νοσολογική οντότητα από την οποία υπολογίζεται ότι θα νοσήσει το 5 με 20% περίπου του γενικού πληθυσμού. Ο μηχανισμός δημιουργίας της, παραμένει εν μέρει μόνο κατανοητός παρ’ όλες τις μέχρι στιγμής προταθείσες θεωρίες. Η φθίση των γνωστικών λειτουργιών είναι συχνά παρούσα και σχετίζεται με τη βαρύτητα της νόσου.
Από τους μηχανισμούς που θεωρείται ότι ενοχοποιούνται για την παθογένεια της κατάθλιψης, ένας αριθμός φαίνεται να είναι κοινός και στη νόσο του Alzheimer. Μάλιστα ένας αυξανόμενος αριθμός δεδομένων συνηγορεί στο ότι η εμφάνιση κατάθλιψης στο ατομικό ιστορικό, μπορεί να αποτελεί παράγοντα κινδύνου για την ανάπτυξη της νόσου Alzheimer, δίνοντας παράλληλα έμφαση τόσο στον αριθμό των καταθλιπτικών επεισοδίων, όσο και στην ηλικία έναρξής τους. Μια πιθανή εξήγηση φαίνεται να είναι και το ότι το χρόνιο στρες που απαντάται συχνά στους καταθλιπτικούς ασθενείς, ενεργοποιεί τους μηχανισμούς που σχετίζονται με την εμφάνιση της νόσου Alzheimer.
Στόχος της παρουσίασης αποτελεί η ανάδειξη της μέχρι σήμερα γνώσης, όσον αφορά στους συσχετισμούς και στους κοινούς βιοχημικούς μηχανισμούς, ανάμεσα στη νόσο Alzheimer και στην κατάθλιψη, προσπαθώντας μ’ αυτό τον τρόπο να κατανοήσει το κατά πόσο η κατάθλιψη αλλά και το χρόνιο στρες, αποτελούν ανεξάρτητο παράγοντα κινδύνου στην ανάπτυξη της νόσου Alzheimer. Εγκέφαλος 2011, 48(3):131-136.
Λέξεις κλειδιά: Χρόνιο στρες, φλεγμονή, παθογένεια κατάθλιψης, άξονας υποθαλάμου-υπόφυσης-επινεφριδίων, γλυκοκορτικοειδή.
Εισαγωγή
Σημαντικός αριθμός επιδημιολογικών μελετών προτείνουν ότι η καταθλιπτική διαταραχή στο ιστορικό του ασθενούς, συσχετίζεται με αυξημένη πιθανότητα ανάπτυξης γνωστικών διαταραχών1,2 και ειδικότερα με τη νόσο του Alzheimer3,4. Είναι βέβαια γνωστό πως κατά τη διάρκεια ενός καταθλιπτικού επεισοδίου κυρίως σε ηλικιωμένα άτομα μπορούν να εμφανιστούν γνωστικές διαταραχές, “δίκην άνοιας”. Αυτές είναι γνωστές ως ψευδοάνοιες. Ο όρος “ψευδοάνοια” χρησιμοποιείται για να περιγράψει μια κλινική εικόνα που χαρακτηρίζεται από κατάθλιψη σε συνδυασμό με ελάττωση των γνωστικών λειτουργιών, η οποία απαντά θετικά στην αντικαταταθλιπτική αγωγή και υποχωρεί με την ύφεσή της, σε αντίθεση με την κλασική άνοια η οποία έχει προοδευτική μορφή5. Η έννοια της ψευδοάνοιας δεν αποτελεί αντικείμενο της παρούσας εργασίας, κατά την οποία θα εξετασθούν οι κοινοί βιοχημικοί τόποι και αιτιολογικοί συσχετισμοί μεταξύ της νόσου Alzheimer και της καταθλιπτικής διαταραχής. Στον πίνακα 1 φαίνονται μερικά διαφοροδιαγνωστικά σημεία μεταξύ άνοιας και ψευδοάνοιας.

Επιδημιολογικά δεδομένα
Αυτό που εξετάσθηκε στις επιδημιολογικές μελέτες, ήταν η χρονική συσχέτιση μεταξύ του ή των καταθλιπτικών επεισοδίων και της έναρξης της ΝΑ, ούτως ώστε να γίνει κατανοητό το κατά πόσο η κατάθλιψη αποτελεί ένα πρόδρομο σύμπτωμα της ΝΑ ή έναν ανεξάρτητο παράγοντα κινδύνου. Η συστηματική μεταανάλυση του Ownby και των συνεργατών του4 που έγινε το 2006 και στην οποία εξετάσθηκαν τα αποτελέσματα δεκάδων επιδημιολογικών μελετών με συνολικό δείγμα 102.000 ασθενών, κατέληξε στο ότι:
Βιοχημικοί συσχετισμοί
Η προσπάθεια σύνδεσης αυτών των ευρημάτων μεταξύ τους καθώς και με το στρες, καταλαμβάνει σημαντικό κομμάτι της σύγχρονης βιβλιογραφίας. Έχει βρεθεί τόσο σε πειραματικό επίπεδο6,7, όσο και σε κλινικό επίπεδο8,9, ότι υπάρχει ισχυρή συσχέτιση μεταξύ στρεσογόνων ερεθισμάτων και ανάπτυξης καταθλιπτικής διαταραχής. Αυτό είναι κάτι που γνωρίζουμε άλλωστε και από την καθημερινή κλινική μας εμπειρία, καθώς είναι κατανοητό πως κάποιος που βιώνει μόνιμα το στρες είναι πιο επιρρεπής στην κατάθλιψη. Σε πιο πρόσφατες μελέτες φάνηκε να υπάρχει αιτιολογική συσχέτιση του στρες και με τις νευροεκφυλιστικές νόσους, ειδικότερα με τη ΝΑ10.
Άξονας υποθαλάμου-υπόφυσης-επινεφριδίων
Εκ των προτέρων οι μηχανισμοί οι οποίοι πυροδοτούνται από τα στρεσογόνα ερεθίσματα είναι προσαρμοστικοί διευκολύνοντας ή αποσκοπώντας στην αποκατάσταση της φυσιολογικής ισορροπίας. Πρόκειται για ορμονικές και βιοχημικές μεταβολές. Γνωρίζουμε ότι το στρες ενεργοποιεί ένα νευροενδοκρινικό μονοπάτι γνωστό ως άξονα υποθαλάμου-υπόφυσης-επινεφριδίων γνωστό και ως HPA άξονα (Εικόνα 1).
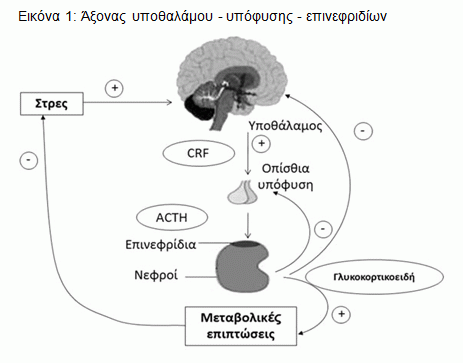
Έτσι λοιπόν τα στρεσογόνα ερεθίσματα ενεργοποιούν τον υποθάλαμο ο οποίος απελευθερώνει τον παράγοντα απελευθέρωσης της φλοιοτρόπου ορμόνης, ή παράγοντα CRF, ο οποίος δρώντας στην υπόφυση ενεργοποιεί την απελευθέρωση της φλοιοεπινεφριδιοτρόπου ορμόνης ή ACTH. Με τη σειρά της η ACTH ενεργοποιεί μέσω της αιματικής κυκλοφορίας την απελευθέρωση γλυκοκορτικοειδών (GC) από τα επινεφρίδια. Τα γλυκοκορτικοειδή (μαζί με τη νορεπινεφρίνη και την επινεφρίνη, που αποδεσμεύονται από το συμπαθητικό νευρικό σύστημα) ευθύνονται κυρίως για τις αλλαγές που επέρχονται στο σώμα κατά τη διάρκεια των στρεσογόνων καταστάσεων για να μεγιστοποιούν την ικανότητά μας να αντιμετωπίζουμε το στρεσογόνο παράγοντα με τον οποίο είμαστε αντιμέτωποι. Οι αλλαγές αυτές περιλαμβάνουν τον αυξημένο καρδιαγγειακό τόνο, τη συγκέντρωση ενέργειας στους μυς, τη διέγερση του ανοσοποιητικού συστήματος, την αναστολή της αναπαραγωγικής φυσιολογίας και της όρεξης, αυξήσεις των ρυθμών εγκεφαλικής αιμάτωσης και όξυνση των νοητικών λειτουργιών11. Τα GC περνούν τον αιματοεγκεφαλικό φραγμό και ασκούν αρνητική παλίνδρομη ρύθμιση (negative feedback loop), στον ιππόκαμπο, υποθάλαμο και υπόφυση, δηλαδή η περίσσεια GC προκαλεί ανάσχεση του άξονα HPA. Τόσο στη μείζονα κατάθλιψη όσο και στη ΝΑ παρατηρούνται ανωμαλίες στην αλληλουχία στρες και άξονα ΗΡΑ με αποτέλεσμα να μην λειτουργεί φυσιολογικά ο μηχανισμός της αρνητικής παλίνδρομης ρύθμισης, γεγονός το οποίο συνεπάγεται αυξημένα επίπεδα GC στον εγκέφαλο12-16. Η περίσσεια των ουσιών αυτών έχει αποδειχθεί πως παίζει κεντρικό παθοφυσιολογικό ρόλο τόσο στην κατάθλιψη12, όσο και στη ΝΑ10 και μάλιστα σχετίζεται με την ελαττωμένη ενεργότητα του δικτύου υποδοχέων των GC. Πιο συγκεκριμένα υψηλή συγκέντρωση γλυκοκορτικοειδών στην αιματική κυκλοφορία του εγκεφάλου συνεπάγεται:
Το τελικό αποτέλεσμα είναι η ελάττωση του όγκου του ιπποκάμπου και του προμετωπιαίου φλοιού, που ανευρίσκεται τόσο στη Νόσο Alzheimer όσο και σε καταθλιπτικούς ασθενείς23. Ο προμετωπιαίος φλοιός ο οποίος προσβάλλεται και αυτός, συνδέεται με τον ιππόκαμπο και είναι δομές σημαντικές για τη ρύθμιση τόσο της διάθεσης, όσο και της μνήμης.
Έτσι λοιπόν το κεντρικό επιχείρημα των όσων παρουσιάστηκαν μέχρι εδώ είναι το ότι το στρες μέσω των GC προκαλεί μια αλληλουχία, μια χιονοστιβάδα γεγονότων σε κυτταρικό και μοριακό επίπεδο τα οποία έχουν ως αποκορύφωμα τόσο διαταραχές της διάθεσης (κατάθλιψη), όσο και γνωστικές.
Φλεγμονώδεις διαδικασίες
Η σχέση μεταξύ στρες και ανοσοποιητικού συστήματος είναι αναγνωρισμένη και η ιδέα ότι οι κυτταροκίνες, ως παράγοντες της φλεγμονής, μπορούν να συμβάλλουν στην κατάθλιψη και τη νευροεκφύλιση, κερδίζει έδαφος. Η συμμετοχή της φλεγμονώδους διαδικασίας στη νόσο Alzheimer έχει κεντρικό ρόλο και αυτό στο οποίο αξίζει να σταθούμε είναι πως μερικά από αυτά τα φαινόμενα ανευρίσκονται και στους καταθλιπτικούς ασθενείς. Ορισμένες κυτταροκίνες (IL-6, IL-1, TNFa), οι οποίες βρίσκονται αυξημένες στην κατάθλιψη, αυξάνονται και στην άνοια και το πιο σημαντικό είναι ότι τέτοια φλεγμονώδη μόρια φαίνεται να εμπλέκονται στην παθογένεια της νόσου Alzheimer, δίνοντας έδαφος στην ιδέα ότι οι δύο διαταραχές μπορεί να προκύπτουν με αλληλοδιάδοχο τρόπο. Πιο συγκεκριμένα η ενεργοποίηση του ανοσοποιητικού συστήματος μέσω της φλεγμονής, μπορεί να θεωρηθεί ότι προάγει την κατάθλιψη με τη δράση των κυτταροκινών οι οποίες είτε εισέρχονται στον εγκέφαλο μέσω της αιματικής κυκλοφορίας, είτε συντίθενται de novo στο ΚΝΣ, και οι οποίες προκαλούν διεργασίες κοινές μ’ αυτές που ενεργοποιούν τα κλασικά στρεσογόνα ερεθίσματα. Υποστηρίζεται μάλιστα πως το στρες και οι κυτταροκίνες μπορούν να δρουν με συνεργικό τρόπο24,25 (Εικόνα 2) προωθώντας την απελευθέρωση των παραγόντων του άξονα ΗΡΑ, γεγονός το οποίο επιδρά στη σεροτονίνη, τις οποίας οι μεταβολές επηρεάζουν την κατάθλιψη, είτε άμεσα, είτε έμμεσα μέσω τις ελάττωσης της πλαστικότητας του εγκεφάλου.
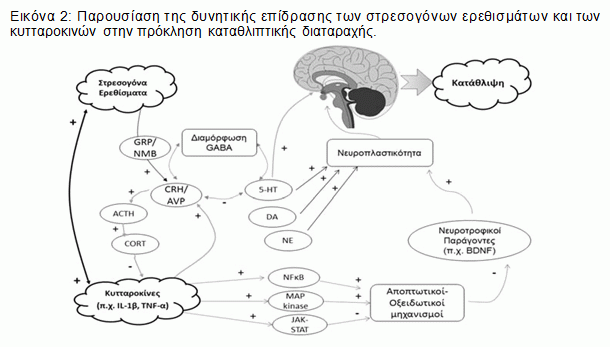
Ο παράγων BDNF
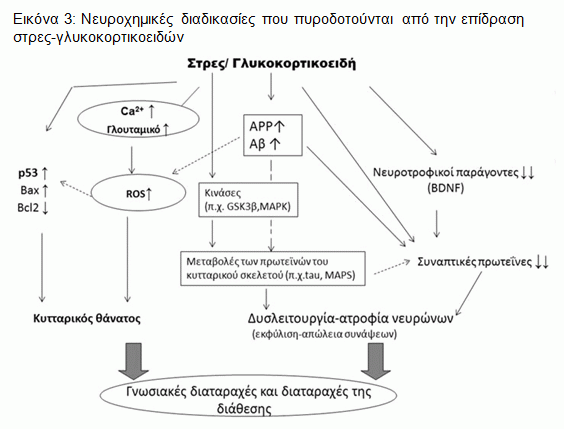
Όπως φαίνεται στην Eικόνα 2, το στρες και οι κυτταροκίνες μέσω της ενεργοποίησης άλλων χημικών παραγόντων (κινασών και πρωτεΐνης MAP) θα μπορούσαν να επηρεάσουν την εξέλιξη αποπτωτικών και οξειδωτικών μηχανισμών, με αποτέλεσμα την αλλοίωση της παραγωγής του νευροτροφικού παράγοντα BDNF (νευροτροφικός παράγοντας εγκεφαλικής προέλευσης), την ελάττωση της πλαστικότητας του εγκεφάλου και την κατάθλιψη26. Η ελάττωση της παραγωγής του παράγοντα BDNF, είναι κάτι που παρατηρείται και στη ΝΑ και μάλιστα μπορεί όπως φαίνεται και στην Eικόνα 3 να προκύψει ως αποτέλεσμα του στρες και της αύξησης των γλυκοκορτικοειδών. Στην ίδια εικόνα βλέπουμε το πώς το στρες και τα GC μπορούν να πυροδοτήσουν τον κυτταρικό θάνατο μέσω αποπτωτικών διαδικασιών με τη συμμετοχή πρωτεϊνών που σχετίζονται με τον κύκλο ζωής του κυττάρου (P53, p21) καθώς και προαποπτωτικών παραγόντων της οικογένειας Bcl-2 και έτσι να σταματήσουν τη νευρογένεση, καθώς και να οδηγήσουν σε ατροφία των νευρώνων μέσω της παραγωγής του Αβ αμυλοειδούς από πρόδρομες ουσίες και την υπερφωσφορυλίωση της tau πρωτεΐνης10.
Επίλογος
Συμπερασματικά, υπενθυμίζεται πως τόσο η κατάθλιψη, όσο και η ΝΑ, είναι ασθένειες με πολυπαραγοντική φύση και σαφώς η αιτιολογία τους δεν μπορεί να εξαντληθεί στην παρούσα εργασία. Παρ’ όλα αυτά φαίνεται πως η επίδραση του χρόνιου στρες μέσω των GC και των άλλων διαδικασιών που περιγράφτηκαν, ασκεί μια σαφέστατα καταστρεπτική δράση, οδηγώντας στην εκδήλωση τόσο καταθλιπτικής διαταραχής, όσο και ΝΑ.
ΒΙΒΛΙΟΓΡΑΦΙΑ