| |||
| |||
Μυασθένεια και ανοσολογικοί δείκτες
ΚΟΥΤΣΟΥΡΑΚΗ Ε.1, ΑΓΓΟΥΡΙΔΑΚΗ
ΧΡ.2, ΚΩΣΤΑ Β.1,
ΔΟΥΜΠΟΓΙΑΣ Ι.2, ΜΠΑΛΟΓΙΑΝΝΗΣ ΣΤ.1
1Α΄Νευρολογική Κλινική Αριστοτελείου
Πανεπιστημίου Θεσσαλονίκης
2Ορολογικό Εργαστήριο Νοσοκομείου ΑΧΕΠΑ
Περίληψις
Η μυασθένια είναι μία αυτοάνοση διαταραχή που χαρακτηρίζεται από αδυναμία
και εύκολη κόπωση των μυών. Εξετάσαμε σε εικοσι-έξι μυασθενικούς ασθενείς, δεκατρείς
άνδρες και δεκατρείς γυναίκες με μέση διάρκεια νοσήσεως τρία χρόνια, καθώς και
σε ισάριθμους υγιείς μάρτυρες, τους ακόλουθους ανοσολογικούς δείκτες: υποπληθυσμούς
λεμφοκυττάρων σε ολικό αίμα, με τη μέθοδο της κυτταρομετρίας ροής, και στο ορό
του αίματος με την ανοσοενζυματική μέθοδο ELIZA, την ιντερλευκίνη 6 καθώς και
τους υποδοχείς αυτής, τον παράγοντα νέκρωσης του όγκου (TNFa) και τα αντισώματα
κατά της γλυκοπρωτεϊνης που σχετίζεται με την μυελίνη (MAG), της γαγγλιοσίδης
GM1 και της γαγγλιοσίδης GD1b. Μελετήθηκαν οι μεταβολές των ανωτέρω ανοσολογικών
δεικτών σε περίοδο έξαρσης των συμπτωμάτων και χωρίς να λαμβάνουν οι ασθενείς
ανοσοκατασταλτικά φάρμακα. Σε όλους τους ασθενείς παρουσιάστηκε αυξημένος ο
λόγος CD4/CD8 που οφειλόταν κυρίως στην αύξηση CD4+ Τ-λεμφοκυττάρων παρά στην
ελάττωση των CD8+ λεμφοκυττάρων. Τα αντισώματα έναντι της MAG ήταν ελαφρώς αυξημένα
σε όλους τους ασθενείς, τα αντισώματα έναντι της GD1b ήταν επίσης αυξημένα,
η ιντερλευκίνη 6 ήταν ελαφρώς αυξημένη σε δεκατρείς ασθενείς, ενώ οι υποδοχείς
αυτής ήταν αυξημένοι σε όλους τους ασθενείς. Ο παράγoντας νέκρωσης του όγκου
και τα αντισώματα έναντι της γαγγλιοσίδης GM1 ήταν σε φυσιολογικές τιμές. Με
βάση τα αποτελέσματα της παρούσας εργασίας μπορούμε να πούμε ότι στη μυασθένεια
υπάρχει μία αυτοάνοση φλεγμονώδης αντίδραση στην οποία συμμετέχουν τα φλεγμονώδη
και κυτταροτοξικά CD4+ Τ-λεμφοκύτταρα και η προφλεγμονώδης IL-6 καθώς και οι
υποδοχείς αυτής.
Λέξεις κλειδιά: Μυασθένεια, ανοσολογικοί δείκτες.
Εισαγωγή
Η μυασθένεια είναι μία αυτοάνοση νόσος που χαρακτηρίζεται από αδυναμία και εύκολη κόπωση των μυών. Η συχνότητα είναι μικρότερη του 1:100.000 (Sorensen and Holm, 1989), παρουσιάζεται συχνότερα σε νέες γυναίκες και σε άνδρες μεγαλύτερους των 50 ετών (Grob et al., 1981). H νόσος οφείλεται σε διαταραχή της νευρομυικής σύναψης λόγω ελαττωμένου αριθμού των υποδοχέων της ακετυλοχολίνης, διεύρυνση της συναπτικής σχισμής και ελαττωμένης ποσότητας της ακετυλοχολίνης που απελευθερώνεται μετά τα πρώτα 5-10 χαμηλού δυναμικού ερεθίσματα. Θεωρείται κλασσικό παράδειγμα αυτοάνοσης διαταραχής που ρυθμίζεται απο αντισώματα και εξαρτάται από τα Τ-λεμφοκύτταρα. Tο 80% των ασθενών με την επίκτητη μορφή της νόσου παρουσιάζει αντισώματα εναντίον της ακετυλοχολίνης (Tindall et al., 1981) ενώ περισσότερο του 50% των ασθενών με την οφθαλμική μορφή της νόσου δεν παρουσιάζουν. Τα αντισώματα συνδέονται με διάφορες θέσεις των υποδοχέων, κυρίως την α-υπομάδα που αποτελεί τη βασική αντιγονική περιοχή, όμως καμία από τις ιδιότητες των αντισωμάτων δεν έχουν ως τώρα συσχετισθεί με την κλινική εικόνα ή τη διάρκεια της νόσου (Tzartos et al., 1982). Γενικά ο τίτλος των αντισωμάτων συνδέεται ασθενώς με τη σοβαρότητα της νόσου αλλά ελαττώνεται μετά θεραπεία με ανοσοκατασταλτικά και κλινική βελτίωση της νόσου (Oosterhuis et al., 1983). Είναι γνωστό ότι η παραγωγή των αντισωμάτων απαιτεί την παρουσία των CD4+ Τ-λεμφοκυττάρων καθώς και των Β-λεμφοκυττάρων (Hohfeld et al., 1986). Πειραματικά μοντέλα της νόσου καταδεικνύουν ότι η ανοσοπαθολογία αρχίζει με την παρούσιαση των υποδοχέων της ακετυλοχολίνης στα Τ-λεμφοκύτταρα (Lennon et al., 1976) που προκαλούν στη συνέχεια την παραγωγή των αντισωμάτων από τα Β-λεμφοκύτταρα. Λόγω της αυτοάνοσης αιτολογίας της νόσου, η οποία δεν έχει ακόμη διευκρινιστεί, οι τρόποι της θεραπευτικής αντιμετώπισης είναι μέσω ανοσοκατασταλτικών παραγόντων. Η πλέον σύγχρονη αντιμετώπιση είναι η ενδοφλέβια χορήγηση γ-ανοσοσφαιρίνης η οποία αναχαιτίζει το Fc τμήμα των αντισωμάτων, αποτρέπει την εναπόθεση και δράση του συμπληρώματος καθώς και των κυττοκίνων.
Υλικά και μέθοδοι
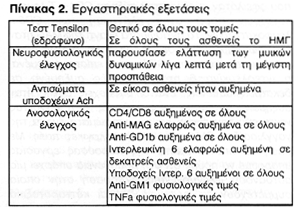
Εξετάσαμε σε εικοσι-έξι μυασθενικούς ασθενείς, δεκατρείς άνδρες και δεκατρείς γυναίκες με μέση διάρκεια νοσήσεως τρία χρόνια, καθώς και σε ισάριθμους υγιείς μάρτυρες, τους ακόλουθους ανοσολογικούς δείκτες: υποπληθυσμούς λεμφοκυττάρων σε ολικό αίμα, με τη μέθοδο της κυτταρομετρίας ροής, και στο ορό του αίματος με την ανοσοενζυματική μέθοδο ELIZA, την ιντερλευκίνη 6 καθώς και τους υποδοχείς αυτής, τον παράγοντα νέκρωσης του όγκου (TNFa), τα αντισώματα κατά της γλυκοπρωτεϊνης που σχετίζεται με την μυελίνη (MAG), της γαγγλιοσίδης GM1 και της γαγγλιοσίδης GD1b.
Στην παρούσα εργασία μελετήθηκαν οι μεταβολές των ανωτέρω ανοσολογικών δεικτών σε περίοδο έξαρσης των συμπτωμάτων και χωρίς να λαμβάνουν οι ασθενείς ανοσοκατασταλτικά φάρμακα.

Αποτελέσματα
Όλοι οι δείκτες ήταν φυσιολογικοί στους υγιείς μάρτυρες. Σε όλους τους ασθενείς παρουσιάστηκε αυξημένος ο λόγος CD4/CD8 (μέση τιμή 2,7, με φυσιολογική τιμή έως 2) που οφειλόταν κυρίως στην αύξηση CD4+ T-λεμφοκυττάρων. Τα αντισώματα έναντι της MAG ήταν ελαφρώς αυξημένα σε όλους τους ασθενείς (μέση τιμή 1200 pg/ml, με φυσιολογική τιμή έως 1000 pg/ml). Τα αντισώματα έναντι της GD1b ήταν επίσης αυξημένα, σε δεκατέσσερεις αφορούσαν τα ΙgG, σε έντεκα τα IgM και σε μία ασθενή αμφότερα. Αυτή η τελευταία παρουσίαζε το μεγαλύτερο χρόνο νοσηλείας (πέντε έτη). Η ιντερλευκίνη 6 ήταν ελαφρώς αυξημένη σε δεκατρείς ασθενείς (μέση τιμή 3,7 με φυσιολογική μικρότερο του 3) ενώ οι υποδοχείς αυτής ήταν αυξημένοι σε όλους τους ασθενείς με μέση τιμή 41000pg/ml και φυσιολογική έως 30000pg/ml. Ο παράγοντας νέκρωσης του όγκου και τα αντισώματα έναντι της γαγγλιοσίδης GM1 ήταν σε φυσιολογικές τιμές.
Συζήτηση
Τα CD4+ Τ-λεμφοκύτταρα, που αποτελούν το 65% των Τ-λεμφοκυττάρων του περιφερικού αίματος, διαδραματίζουν βασικό ρόλο στη ρύθμιση των περισσοτέρων ανοσολογικών λειτουγιών και των κυττάρων μνήμης οδηγώντας στην προστασία του οργανισμού από τους ξενιστές. Αυτά τα κύτταρα εκλεκτικά αναγνωρίζουν βραχέα πεπτιδικά αντιγόνα και συνεργάζονται με το μείζονα σύμπλεγμα ιστοσυμβατότητας τύπου ΙΙ (Jensen, 1997). Προάγουν τη φλεγμονώδη αντίδραση και επιπλέον είναι κυτταροτοξικά (Fleisher, 1997).
τα CD8+ Τ-λεμφοκύτταρα αποτελούν το 35% των Τ-λεμφοκυττάρων και λειτουργούν κατασταλτικά στη φλεγμονώδη διεργασία. Συνεργάζονται με το μείζονα σύμπλεγμα ιστοσυμβατότητας τύπος Ι (Martin και Mc Farland, 1995) και συμβάλλουν στην παθογένεια των οργανοειδικών αυτοάνοσων ασθενειών. Υπάρχουν ενδείξεις ότι συμμετέχουν στην καταστροφή των ιστών χωρίς ακόμη να γνωρίζουμε από ποιά αντιγόνα ενεργοποιούνται.
Η ιντερλευκίνη 6 και οι υποδοχείς αυτής ανήκουν στις προφλεγμονώδεις κυττοκίνες που προάγουν επίσης την φλεγμονώδη αντίδραση. Ανήκουν στη μεγάλη οικογένεια των κυττοκίνων που αποτελείται από βραχείας αλύσου πρωτεϊνες 8-10 KD και οι υποδοχείς τους συνδέονται με συγκεκριμένες G πρωτεϊνες της επιφάνειας των κυττάρων. Διαδραματίζουν κεντρικό ρόλο στις χρόνιες νευρολογικές ασθένειες ιδιαίτερα αυτοάνοσης αιτιολογίας (Calabresi et al., 1999, Bacon and Harrison, 2000). Τρείς βασικές ιδιότητες των κυττοκίνων μας βοηθούν στην κατανόηση της αυτοάνοσης λειτουργίας: παράγονται από ενεργοποιημένα κύτταρα, η δράση τους είναι κυτταροειδική και συναντόνται και σε περιοχές πολύ απομακρυσμένες από τη θέση των κυττάρων από τα οποία παράγονται (Owens, 1998).
Με βάση τα αποτελέσματα της παρούσας εργασίας μπορούμε να πούμε ότι στη μυασθένεια υπάρχει μία αυτοάνοση φλεγμονώδης αντίδραση στην οποία συμμετέχουν τα φλεγμονώδη και κυτταροτοξικά CD4+ Τ-λεμφοκύτταρα και η προφλεγμονώδης IL-6 καθώς και οι υποδοχείς αυτής. Παρατηρούμε όμως ότι υπάρχει και μία γενικώτερη ανοσολογική αντίδραση που δεν σχετίζεται με την αυτοάνοση λειτουργία έναντι των υποδοχέων της ακετυλοχολίνης και εκφράζεται με αυξημένα αντισώματα έναντι των γαγγλιοσιδών. Το παραπάνω στοιχείο καταδεικνύει ότι μία αυτοάνοση αντίδραση ξεκινάει οργανοειδικά αλλά στη συνέχεια γενικεύεται και εναντίον άλλων στόχων που ίσως έχουν κοινά στοιχεία στην πεπτιδική τους άλυσο με τον αρχικό στόχο. Τα αυξημένα αντισώματα έναντι των γαγγλιοσιδών καταδεικνύουν εμμέσως τη διαταραχή της ενδοκυτταρώσεως των υποδοχέων και μπορούν να ερμηνεύσουν την ετοιμότητα την οποία παρουσιάζουν οι πάσχοντες προς μυασθενική κρίση, όταν αυτά είναι υπέρμετρα αυξημένα.
Καταλήγοντας μπορούμε να πούμε ότι πρέπει να γίνει μία ευρύτερη ανοσολογική διερεύνηση της μυασθένειας που θα μας βοηθήσει στην κατανόηση και θεραπευτική αντιμετώπιση της νόσου.
ΒΙΒΛΙΟΓΡΑΦΙΑ