|
|||
|
|||
Αντισώματα έναντι GM1, IL6 και IL6R στον ορό ασθενών με πολυνευροπάθειες
ΧΑΤΖΗΦΙΛΙΠΠΟΥ Ε., ΚΟΥΤΣΟΥΡΑΚΗ E., ΚΩΣΤΑ Β., ΜΠΑΛΟΓΙΑΝΝΗΣ Σ.
Νευροανοσολογικό Εργαστήριο, 1η Νευρολογική Κλινική, Αριστοτέλειο Πανεπιστήμιο, Νοσοκομείο ΑΧΕΠΑ, Θεσσαλονίκη
Διευθυντής: Σ.Ι. Μπαλογιάννης
Περίληψη
Στόχος της έρευνας ήταν η εξακρίβωση και συσχέτιση της συγκέντρωσης των παραγόντων Anti-GM1 ΙgM, IL-6 και IL-6R στον ορό αίματος ασθενών με πολυνευροπάθειες. Εξετάστηκαν 20 ασθενείς (12 γυναίκες, 8 άνδρες) ηλικίας 17-78 ετών. Όλοι οι ασθενείς έπασχαν από πολυνευροπάθειες βάσει κλινικής και νευροφυσιολογικής εξέτασης. Τo GM1, IL-6 και IL-6R του ορού προσδιορίστηκαν χρησιμοποιώντας ELISA kits.
Παρατηρήθηκε, ότι 90% εκδήλωναν αντισώματα κατά του GM1. Ασθενείς στον ορό των οποίων η συγκέντρωση του IL-6 ήταν υψηλότερη από 12.5 pg/ml, ήταν περισσότεροι από εκείνους με φυσιολογικές τιμές της IL-6. Ασθενείς με αυξημένα επίπεδα IL-6 παρουσίασαν χαμηλές συγκεντρώσεις του IL-6R (κάτω από 49 ng/ml). Τα αποτελέσματα της έρευνάς μας είναι καθοριστικά για τον ρόλο των anti-GM1 αντισωμάτων στην διάγνωση των πολυνευροπαθειών καθως επίσης και της IL-6 για την διάγνωση της φλεγμονώδους πορείας.
Λέξεις κλειδιά: Αντισώματα έναντι GM1, ιντερλευκίνη 6, υποδοχέας της ιντερλευκίνης 6, πολυνευροπάθειες.
Εισαγωγή
Το ανοσοποιητικό σύστημα μπορεί να προσβάλλει τους νευρικούς ιστούς με καταστροφικές κλινικές συνέπειες. Μηχανισμοί που πραγματοποιούνται με τη μεσολάβηση είτε ανοσοσφαιρινών είτε κυττάρων, μπορεί να ευθύνονται για την παθογένεια των πολυνευροπαθειών1.
Οι πολυνευροπάθειες ειναι απομυελινωτικά νοσήματα, που οδηγούν σε χρονίως εξελισσόμενες καταστάσεις. Σημαντικό ρόλο στη δημιουργία και εξέλιξη της φλεγμονώδους αντίδρασης των απομυελινωτικών νοσημάτών παρουσιάζουν οι κυττοκίνες, όπως η Ιντερλευκίνη 6 (IL-6) και ο διαλυτός υποδοχέας της (IL-6R)2,3.
Τα μακροφάγα είναι γνωστές πηγές της IL-6 και αποτελούν υποψήφια κύτταρα, τα οποία στις πολυνευροπάθειες προβάλλουν στην επιφάνειά τους την IL-6. Η δράση τους πραγματοποιείται με το να προσβάλλουν την μυελίνη, η οποία περιβάλλει τους υγιείς νευράξονες. Τα μακροφάγα στο εσωτερικό των νευρώνων δρούν ως τοπικά κύτταρα, που εκθέτουν τα αντιγόνα στην επιφάνειά τους, χάρη στην ικανότητα που έχουν, να παρουσιάζουν σε αυτήν τα μείζον συμπλέγματα ιστοσυμβατότητας και τα συνενεργά μόρια Β7, συμμετέχοντας έτσι στην ανοσολογική διαδικασία1,4,5.
Μακροφάγα που κυκλοφορούν στο αίμα, οδηγούνται στο περιφερικό νεύρο μαζί με Τ-κύτταρα, με την δράση μορίων προσκολήσεως (CAMs), μεταλλοπρωτεασών της μήτρας (MMPs) και χημειοτακτικών σημάτων1,4,5. Μέσα στο νεύρο, τα μακροφάγα ρυθμίζουν την φλεγμονή με την έκκριση προ-φλεμονικών κυττοκινών, όπως η IL-6 και το TNFa. Κατόπιν οδηγούνται στους στόχους τους κυρίως μέσω αυτοαντισωμάτων και επιτίθενται με τρόπο μέσω υποδοχέων εξαρτώμενων από το σύστημα συμπληρώματος1,4,5. Επίσης με την μη ειδική φθορά ιστού μέσω κυττοτοξικών ριζών και άλλων τοξικών εκκριτικών προϊόντων, συμπεριλαμβανομένων των κυττοκινών, προκαλούν τελικά την εκφύλιση του άξονα6,7.
Ένας ακόμη παράγοντας ο οποίος φαίνεται να παίζει σημαντικό ρόλο στα απομυελινωτικά νοσήματα, είναι τα αντισώματα κατά των γαγγλιοσιδίων.
Τα γαγγλιοσίδια είναι όξινα γλυκοφωσφολιπίδια, τα οποία εντοπίζονται στην εξωτερική στιβάδα των πλασματικών μεμβράνών και περιέχουν ένα μόριο σιαλικού οξέος (GM1) είτε δύο (GM2), συνήθως Ν-ακέτυλο-νοϊραμινικό οξύ, συνδεδεμένο σε ένα ολιγο-γλυκοζυλιωμένο κατάλοιπο και μια βάση κεραμιδίου8. Το υδρόφοβο κεραμίδιο που βρίσκεται ανάμεσα στην λιπιδική μεμβράνη και το υδρόφιλο καρβοξυλικό άκρο, εκτίθεται εξωκυτταρικά, όπως συμβαίνει στην περίπτωση των πλασματικών μεμβρανών, και λειτουργεί ως στόχος αντισωμάτων8,9.
Παρόλη την πληθώρα στοιχείων για τη δομή των γαγγλιοσιδίων και τον μεταβολισμό τους, λίγα είναι γνωστά γύρω από τις λειτουργίες τους. Πρόσφατες έρευνες έδειξαν, ότι τα γαγγλιοσίδια προκαλούν ποικίλες κινητικές νευρολογικές παθήσεις.
Τα αντισώματα κατά των γαγγλιοσιδίων εντοπίζονται σε ασθενείς με κατεστραμμένους νευράξονες και δρούν ενάντια στην κατασκευή Gal(β1-3)GalNAc του καρβοξυλικού τμήματος του μορίου, το οποίο μοιράζονται πολλές γλυκοπρωτεΐνες στο περιφερικό νεύρο9,10.
Μια τυπική αυτοάνοση πολυνευροπάθεια, η οποία έχει μέχρι σήμερα μελετηθεί περισσότερο από άλλες, είναι το σύνδρομο Guillain-Barre (GBS). Οι ασθενείς με GBS εκδηλώνουν αντισώματα κατά του γαγγλιοσιδίου GM111,12,13. Σχεδόν το ένα τέταρτο των ασθενών με GBS είχαν κάποια βακτηριακή μόλυνση. Ο λιπο-ολιγοσακχαρίτης του βακτηριακού τοιχώματος περιέχει κατασκευές παρόμοιες με τα γαγγλιοσίδια, οι οποίες ενεργοποιούν τα Β-κύτταρα, για να παράγουν αντισώματα. Τα αντισώματα αυτά περνούν τον αιματοεγκεφαλικό φραγμό και καταστρέφουν αντιγόνα, με τη γνωστή οψωνινοποίηση, ενεργοποιούν το συμπλήρωμα και τέλος οδηγούν τα μακροφάγα να εισβάλλουν στο χώρο γύρω από τον άξονα, έιτε προκαλούν την εκφύλισή του11,12,14.
Σύμφωνα με in vivo και in vitro έρευνες το GM1 έχει αντι-νευροτοξικές και νευροπροστατευτικές ικανότητες. Οι μελέτες αυτές παρoυσιάζουν και στηρίζουν άλλες έρευνες, οι οποίες παρατήρησαν, ότι το GM1 έχει και νευροτροφική δράση15.
Ο σκοπός της μελέτης μας, ηταν να ερευνήσουμε και να συσχετίσουμε την συγκέντρωση των anti-GM1 IgM, IL-6 και IL-6R στον ορό ασθενών με πολυνευροπάθειες. Τα αποτελέσματά μας είναι ενδεικτικά για τον ρόλο των anti-GM1 αντισωμάτων στη διάγνωση των πολυνευροπαθειών και της IL-6 στη διάγνωση της φλεγμονώδους πορείας.
Ασθενείς και μέθοδοι
Ασθενείς
Εξετάσαμε 20 ασθενείς, ηλικίας από 17-78 ετών, με ποσοστό ανδρών προς γυναίκες 1:2 και μέσο όρο 57 έτη για τις γυναίκες και 49 έτη για τους άνδρες. Αναφερώμενοι στον τύπο της νόσου, 14 ασθενείς (70%) παρουσίασαν κινητική πολυνευροπάθεια, 4 (20%) αισθητικό-κινητικό τύπο και 2 ασθενείς (10%) έπασχαν από αισθητική μορφή της νόσου (Πίνακας 1).
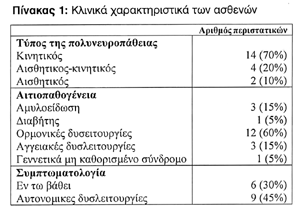
Η αιτιολογία της νόσου ήταν πολλαπλή. 15% έπασχαν από αμυλοείδωση, 5% από διαβήτη καθώς επίσης από γεννετικό μη καθορισμένο σύνδρομο. 60% παρουσίασαν ορμονικές δυσλειτουργίες και 30% εμφάνισαν εν τω βάθει συμπτώματα. Οι προαναφερώμενοι ασθενείς και τρεις ακόμη παρουσίασαν επίσης αυτονομικές δυσλειτουργίες (Πίνακας 1).
Οι περισσότεροι ασθενείς παρουσίαζαν αδυναμία και μούδιασμα των κατώτερων και κατά μικρότερο ποσοστό, των ανώτερων άκρων.
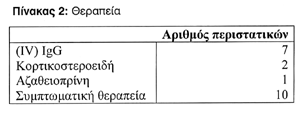
Όσον αφορά τη θεραπευτική αγωγή που ακολουθήθηκε στον κάθε ασθενή, επτά έλαβαν (IV) IgG, βαθμιαία αυξανώμενη σε 0,4 mg/kg, δύο ασθενείς έλαβαν κορτικοστεροειδή, ένας αζαθειοπρίνη και στους υπόλοιπους ακολουθήθηκε μόνο συμπτωματική θεραπεία. Όλοι οι ασθενείς παρουσίασαν βελτίωση (Πίνακας 2).
Δείγματα oρρού
Περιφερικό φλεβικό αίμα συλλέχθηκε και φυγοκεντρήθηκε 10 λεπτά στις 2000 x g. Τα υπερκείμενα διαχωρίσθηκαν και καταψύχθηκαν στους -400 °C μέχρι τη στιγμή του προσδιορισμού. Η συγκέντρωση των GM1-IgM, IL-6 και sIL-6R προσδιορίστηκαν στον ορό χρησιμοποιώντας την ανοσοενζυμική τεχνική ΕLISA.
Αποτελέσματα
Anti-GM1 IgM Assay
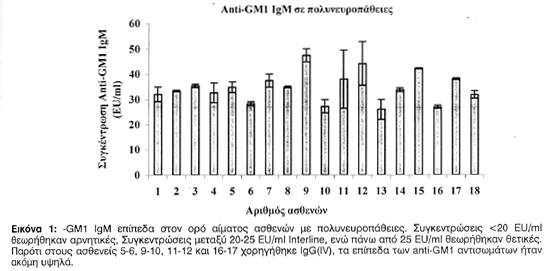
Σύνολο 20 ασθενείς εξετάστηκαν για την παρουσία anti-GM1 IgM. Θεωρήθηκαν θετικές συγκεντρώσεις του anti-GM1 IgM υψηλότερες από 25 EU/ml με αραίωση 1:200. Σύμφωνα με τα αποτελέσματά μας, αυξημένες GM1 συγκεντρώσεις (34,74 EU/ml) προσδιορίστηκαν σε 18 (90%) ασθενείς, ενώ μόνο 2 ασθενείς (10%) εμφάνισαν χαμηλά επίπεδα GM1-IgM (κάτω από 25 EU/ml). Παρόλο που μερικοί ασθενείς (εικ. 1) έλαβαν IgG (IV), τα επίπεδα του GM1-IgM ήταν ακόμη πάνω από 25 EU/ml.
IL-6 & sIL-6R Assays
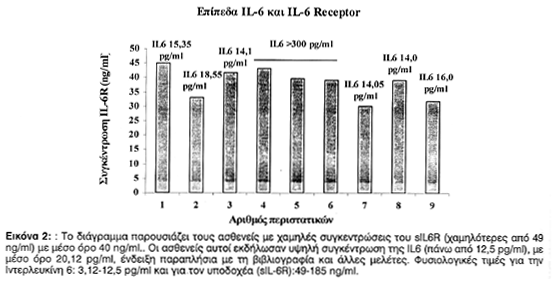
Από τους 18 ασθενείς οι οποίοι παρουσίασαν θετικά GM1, σε 15 (75%) τα επίπεδα της IL-6 ήταν πάνω από 12,5 pg/ml, με μέσο όρο 20,12 pg/ml και μόνο 3 ασθενείς (15%) εμφάνισαν φυσιολογικές τιμές της IL-6, της τάξεως μεταξύ 3,12-12,5 pg/ml.
Εννέα εκ των ασθενών με υψηλές συγκεντρώσεις της IL-6 εμφάνισαν κατά 45% χαμηλή συγκέντρωση του sIL-6R, με μέσο όρο 40 ng/ml και εννέα ασθενείς παρουσίασαν φυσιολογικές τιμές του sIL-6R, της τάξεως μεταξύ 49-185 ng/ml (Πίνακας 3).

Συμπέρασμα
Στην παρούσα έρευνα εξετάστηκαν τρεις παράγοντες: anti-GM1 IgM, IL-6 και sIL-6R στον ορό αίματος 20 ασθενών με πολυνευροπάθειες (12 γυναίκες και 8 άνδρες), ηλικίας 17-78 ετών. Οι περισσότεροι εκ των ασθενών έπασχαν από κινητικού τύπου πολυνευροπάθεια και κάποιοι άλλοι από αισθητική είτε αισθητική-κινητική μορφή της νόσου. Στους περισσότερους ασθενείς χορηγήθηκε IgG (IV) και όλοι παρουσίασαν κλινική βελτίωση.
Σύμφωνα με τα αποτελέσματά μας 90 % των ασθενών εμφάνισαν αυξημένα επίπεδα του anti-GM1 IgM (34,74 EU/ml) σε αραίωση 1:200. Η ένδειξη αυτή φανερώνει, ότι οι ασθενείς, ιδιαίτερα με κινητικού τύπου πολυνευροπάθεια, παράγουν αυξημένα επιπεδα αντισωμάτων κατά του GM1, γεγονός που προκαλεί την απομυελίνωση των περιφερικών νεύρων.
Προηγούμενες μελέτες έδειξαν, ότι αυξημένα επίπεδα αντι-σουλφατιδίων IgM (πάνω από 1/8000) υπήρξαν προγνωστικά για την χρόνια απομυελινωτική νευροπάθεια16. Υψηλοί τίτλοι anti-GM1 IgM και anti-GD1a αναφέρονται επίσης σε ασθενείς με κινητική νευροπάθεια καθώς επίσης και με άνοια17.
Παρά το γεγονός ότι στους εξετασθέντες ασθενείς χοργήθηκε ανοσοσφαιρίνη Γ ενδοφλεβίως, ανιχνεύτηκαν στον ορό του αίματος υψηλά επίπεδα anti-GM1 IgM.
Το γεγονός αυτό δείχνει, ότι η θεραπεία θα πρέπει να ακολουθηθεί για περισσότερο απο έξη μήνες, προκειμένου τα αντισώματα κατά του GM1 να επανέλθουν σε φυσιολογικά πλαίσια.
Προηγούμενες έρευνες που αφορούσαν τη θεραπεία πολυνευροπαθειών, όπως π.χ την χρόνια φλεγμονώδη απομυελινωτική πολυνευροπάθεια (CIDP) έιτε την myasthenia gravis, πα ανίχνευσαν χαμηλά επίπεδα anti-GM1 όχι ομως αμέσως μετά από χορήγηση (IV)Ig, καθώς επίσης και βελτίωση των ασθενών14. Αναφέρουν ακόμη πτώση του τίτλου αντισωμάτων στους μισούς ασθενείς 5 μέρες μετά τη χορήγηση (IV)Ig. Ωστόσο με βάσει τα στοιχεία τους, βελτίωση μετά από θεραπεία με (IV)Ig δεν μπορούσε να συσχετιστεί με την μείωση της συγκέντρωσης του τίτλου των anti-GM1 αντισωμάτων13,14.
Πρόσφατες μελέτες, οι οποίες αφορούν την θεραπεία με (IV)Ig στην πολυεστιακή κινητική πολυνευροπάθεια, επισημαίνουν την βελτίωση 80% των εξεταζομένων ασθενών μετά από 7 μήνες18,20.
Παρόμοιες έρευνες στην οξεία κινητική αξονική νευροπάθεια έδειξαν, ότι η (IV)Ig πιθανώς να μην επηρεάζει την παραγωγή και τον καταβολισμό του anti-GM1 IgG, αλλά αποτρέπει την εκφύλιση των κινητικών νεύρων19.
Ο μηχανισμός με τον οποίο δρά η ανοσοσφαιρίνη δεν είναι ακόμη σαφής. Σύμφωνα με κάποιες έρευνες, υπάρχει η η πιθανότητα, να αναστέλλει η (IV)Ig την αντίδραση μεταξύ της τοξίνης της χολέρας και του GM1 μέσω των F(ab)2 τμημάτων της IgG21.
Σύμφωνα με τα αποτελέσματά μας, το 75% των ασθενών με υψηλά επίπεδα anti-GM1 παρουσίασαν αυξημενες τιμές της IL-6 (20,12 pg/ml).
Η συμμετοχή της IL-6 στην ανοσοποιητική απόκριση σε πονευροπάθειες αποδεικνύεται με την ανίχνευση στον ορό αυτών των ασθενών αυξημένων επιπέδων της IL-6. Κατά αυτόν τον τρόπο μπορέσαμε να συσχετίσουμε την παρουσία υψηλών επιπέδων anti-GM1 IgM στον ορό και αυξημένων τιμών της IL-6.
Προηγούμενες έρευνες, οι οποίες αφορούσαν τον τίτλο της ιντερλευκίνης 6 στον ορό ασθενών με GBS, παρατήρησαν αύξηση των επιπέδων της IL-6 ιδιαίτερα στις προχωρημένες φάσεις της νόσου22.
Σύμφωνα με άλλες μελέτες χαμηλά επίπεδα ιντερλευκίνης 6 ανιχνεύτηκαν στον ορό και στο εγκεφαλονωτιαίο υγρό ασθενών με πολλαπλή σκλήρυνση23. Ωστόσο πρόσφατα στοιχεία αναφέρουν υψηλά επίπεδα της IL-6 στον ορό ασθενών με σκλήρυνση, ενώ υψηλές συγκεντρώσεις του sIL-6R ανιχνεύτηκαν στο εγκεφαλονωτιαίο υγρό των ασθενών αυτών24a,24b.
Είναι γνωστό, ότι η IL-6 ασκεί τη βιολογική της δράση με τη σύνδεσή της στον ειδικό υποδοχέα της IL-6R. Με βάσει τα αποτελέσματά μας 45% των ασθενών που παρουσίασαν υψηλά επίπεδα IL-6, εμφάνισαν χαμηλές συγκεντρώσεις του sIL-6R (40 ng/ml).
Η συχνότητα χαμηλής συγκέντρωσης του sIL-6R δεν διέφερε από αυτήν των ασθενών με φυσιολογικές τιμές sIL6R. Ωστόσο τα στοιχεία μας που αφορούν τη σχέση sIL-6R και IL-6 ενισχύουν άλλες μελέτες.
Η έρευνά μας συνεχίζεται, προκειμένου να διαπιστωθεί η ακριβής δράση των αντισωμάτων κατά του GM1 στις πολυνευροπάθειες, όπως επίσης των IL-6 και του υποδοχέα της (sIL-6R) για την συσχέτιση μεταξύ της θεραπείας με IgG και επιπέδων των τριών αυτών παραγόντων.
ΒΙΒΛΙΟΓΡΑΦΙΑ