|
|||
|
|||
Μία σύγχρονη νευροβιολογική προσέγγιση των διαταραχών πρόσληψης της τροφής
ΑΝΤΩΝΑΤΟΣ Σ.1, ΓΑΛΑΝΟΠΟΥΛΟΥ Π.2
1Ψυχίατρος, Διδάκτωρ Ιατρικής Σχολής Αθηνών
2Αναπληρώτρια Καθηγήτρια Φαρμακολογίας Ιατρικής Σχολής Αθηνών
Περίληψη
Οι διαταραχές της όρεξης έχουν αποτελέσει ένα από τα σύγχρονα πεδία έρευνας της Νευροβιολογίας και της Φαρμακολογίας, ιδίως μετά τη διαπίστωση ότι οι λαίμαργες απαιτήσεις για κατανάλωση υδατανθράκων ή εύγευστης γενικότερα τροφής παρατηρείται συχνότερα σε άτομα με ψυχιατρικές παθήσεις και κυρίως σε ασθενείς με διαταραχές πρόσληψης της τροφής.
Η ρύθμιση της διατροφικής συμπεριφοράς αποτελεί αναμφίβολα μία ιδιαίτερα πολύπλοκη διαδικασία. Πρόσφατα δεδομένα σε μοριακούς και γενετικούς μηχανισμούς σχετικούς με τη ρύθμιση της όρεξης και του σωματικού βάρους, συγκλίνουν στην άποψη ότι η τελική ολοκλήρωση της πρόσληψης τροφής, οι διαιτητικές προτιμήσεις και η διατήρηση του σωματικού βάρους σε επιτρεπτά όρια εξασφαλίζονται μέσω μίας λεπτής ισορροπίας στη συγκέντρωση πολυάριθμων πεπτιδίων και νευροπεπτιδίων τα οποία αλληλεπιδρούν με μονοαμίνες και νευρικά ερεθίσματα σε περιοχές του υποθαλάμου. Μεταξύ των μονοαμινών που η δράση τους εμπλέκεται στη ρύθμιση της διατροφικής συμπεριφοράς περιλαμβάνεται και η σεροτονίνη.
Η σεροτονίνη (5-ΗΤ) ασκεί ανασταλτικό ρόλο στην όρεξη και έχει αποτελέσει στόχο για την ανάπτυξη φαρμάκων κατά της υπερφαγίας και της βουλιμίας, συμπτώματα που χαρακτηρίζουν ασθενείς με διαταραχές πρόσληψης τροφής. Υφίσταται στενή σχέση μεταξύ κορεσμού, διαιτητικών προτιμήσεων και σεροτονινεργικής δραστηριότητας. Ωστόσο παραμένει άγνωστος ο ακριβής ρόλος των υποδοχέων της 5-ΗΤ στον κορεσμό καθώς και στην επιλογή τροφής εμπλουτισμένης σε υδατάνθρακα, λίπος ή πρωτεΐνη.
Σκοπός της μελέτης είναι η διερεύνηση του ρόλου των 5-HT1A και 5-HT2C υποδοχέων στην πρόσληψη και επιλογή τροφής εμπλουτισμένης σε υδατάνθρακα ή πρωτεΐνη αλλά με σταθερή την περιεκτικότητα σε λίπος. Χρησιμοποιήθηκαν 20 ομάδες αρσενικών επιμύων γένους Wistar που έλαβαν: φυσιολογικό ορό, βουσπιρόνη, μεσουλεργίνη, m-CPP, συνδυασμούς των 3 ουσιών και απομορφίνη. Ελάμβαναν ισοθερμιδικής αξίας Τροφή Εμπλουτισμένη σε Υδατάνθρακα (ΤΕΥ) ή Πρωτεΐνη (ΤΕΠ) αντίστοιχα. Χρησιμοποιήθηκε το πειραματικό μοντέλο κυκλικής στέρησης τροφής.
Η μεσουλεργίνη οδηγεί σε πρόσληψη και επιλογή τροφής με διπλό τρόπο δράσης: αφενός αυξάνει την ΤΕΠ όπως ακριβώς η απομορφίνη, ένας καθαρά ντοπαμινεργικός αγωνιστής, αφετέρου αυξάνει την ΤΕΥ ως ανταγωνιστής των 5-HT2C υποδοχέων. Η βουσπιρόνη μέσω δράσης στους 5-HT1A υποδοχείς επηρεάζει έμμεσα την πρόσληψη και επιλογή τροφής. Ο αποκλεισμός των 5-HT2C παρά η αναστολή απελευθέρωσης 5-ΗΤ μέσω των 5-HT1A αυτοϋποδοχέων είναι η σημαντικότερη συνθήκη για να αυξηθεί η πρόσληψη του υδατάνθρακα. Τα δεδομένα συνηγορούν υπέρ της άποψης ότι οι 5-HT2C υποδοχείς διαδραματίζουν τον σημαντικότερο ρόλο στις ανορεξιογόνες ιδιότητες της 5-ΗΤ.
Τα ευρήματα αυτά διευρύνουν το πεδίο κατανόησής μας στο νευροβιολογικό υπόστρωμα της όρεξης και των διαταραχών πρόσληψης της τροφής και συμβάλλουν σε πειραματικές μελέτες που αφορούν νέα φάρμακα εναντίον της υπερφαγίας, της βουλιμίας και της παχυσαρκίας, ειδικά σε εκείνες τις ουσίες με 5-HT2C αγωνιστικές ιδιότητες.
Λέξεις κλειδιά: Διαταραχές πρόσληψης τροφής, σεροτονινεργικό σύστημα, 5-HT2C υποδοχείς, ισοθερμιδικές δίαιτες, πρωτεΐνη, υδατάνθρακας, κυκλική στέρηση τροφής, wistar επίμυες, βουσπιρόνη, μεσουλεργίνη, m-CPP, απομορφίνη.
Εισαγωγή
Η ψυχογενής ανορεξία, η ψυχογενής βουλιμία, η υπερφαγική διαταραχή αλλά και η παχυσαρκία περιλαμβάνονται με διακριτή συμπτωματολογία στη νοσολογική κατηγορία των διαταραχών πρόσληψης τροφής1. Έχει αναφερθεί ότι σε διάφορες εκφάνσεις τους αφορούν έως και το 4% των εφήβων και των νέων ενηλίκων2. Η θεραπευτική προσέγγισή τους βασίζεται σε ένα πολύτροπο μοντέλο. Το προτεινόμενο μοντέλο αναγνωρίζει ότι οι διαταραχές αυτές δεν οφείλονται σε μία και μοναδική αιτία ούτε διαθέτουν μία προβλεπόμενη πορεία3. Βιολογικοί, γενετικοί, κοινωνικοί, ψυχολογικοί και ψυχοδυναμικοί παράγοντες εμπλέκονται στην αιτιολογία των διαταραχών πρόσληψης της τροφής2,3.
Πιο συγκεκριμένα, η βιολογική ευαλωτότητα που χαρακτηρίζει τις διαταραχές αυτές αφορά εκτός των άλλων παραμέτρων και στη δυσλειτουργία των νευρομεταβιβαστικών συστημάτων της σεροτονίνης (5-HT), της ντοπαμίνης (DA) και της νορεπινεφρίνης (NE), τα οποία ρυθμίζουν τη διαιτητική συμπεριφορά2,3. Πλήθος από σχετικές μελέτες έχουν καταδείξει ότι και τα τρία προαναφερθέντα συστήματα των νευρομεταβιβαστών εμφανίζονται να δυσλειτουργούν σε ασθενείς με διαταραχές πρόσληψης της τροφής, ιδίως εκείνο της σεροτονίνης5-7. Αυξημένα επίπεδα σεροτονίνης στον εγκέφαλο μειώνουν την επιθυμία πρόσληψης τροφής, ενώ η συμπεριφορά υπερφαγίας αποδίδεται σε διαταραχή της λειτουργίας της σεροτονίνης1. Η χρήση των εκλεκτικών αναστολέων επαναπρόσληψης της σεροτονίνης (SSRIs) στους οποίους ασθενείς με διαταραχές πρόσληψης τροφής ανταποκρίνονται σε άλλοτε άλλο βαθμό, ενισχύει επίσης με τη σειρά της την άποψη περί δυσλειτουργίας του σεροτονινεργικού συστήματος του εγκεφάλου2,8.
Πρόσφατα δεδομένα σε μοριακούς και γενετικούς μηχανισμούς που αναφέρονται στη ρύθμιση της όρεξης και του σωματικού βάρους, συγκλίνουν στην άποψη ότι η τελική ολοκλήρωση της πρόσληψης τροφής, οι διαιτητικές προτιμήσεις καθώς και η διατήρηση του σωματικού βάρους σε επιτρεπτά όρια εξασφαλίζονται μέσω μίας λεπτής ισορροπίας στη συγκέντρωση πολυάριθμων πεπτιδίων και νευροπεπτιδίων που αλληλεπιδρούν με μονοαμίνες και νευρικά ερεθίσματα σε περιοχές του υποθαλάμου9-11. Μεταξύ των μονοαμινών αυτών περιλαμβάνεται και η σεροτονίνη, η οποία ασκεί ανασταλτικό ρόλο στην όρεξη και έχει αποτελέσει στόχο για την ανάπτυξη φαρμάκων κατά της υπερφαγίας6,7. Ειδικότερα, κλινικές και προ-κλινικές μελέτες που διεξήχθησαν τόσο σε ανθρώπους όσο και σε πειραματόζωα έχουν δείξει ότι η χορήγηση εκλεκτικών παραγόντων απελευθέρωσης και αναστολής επαναπρόσληψης της σεροτονίνης (SSRIs) όπως η φενφλουραμίνη (fenfluramine), η φλουοξετίνη (fluoxetine) και η σερτραλίνη (sertraline) επιφέρουν μείωση στην πρόσληψη της τροφής και του σωματικού βάρους12-16. Αντιθέτως, οι σεροτονινεργικοί ανταγωνιστές ευοδώνουν την πρόσληψη της τροφής16-18.
Οι διαταραχές πρόσληψης τροφής έχουν αποτελέσει ένα από τα σύγχρονα πεδία έρευνας της Φαρμακολογίας, ιδίως μετά τη διαπίστωση ότι η βουλιμία και οι λαίμαργες απαιτήσεις για κατανάλωση υδατανθράκων ή εύγευστης γενικότερα τροφής παρατηρούνται συχνά στους ασθενείς αυτούς1,2. Υφίσταται στενή σχέση μεταξύ κορεσμού, διαιτητικών προτιμήσεων και σεροτονινεργικής δραστηριότητας5. Η σεροτονίνη στα πλαίσια της υποφαγίας που προκαλεί τόσο σε ανθρώπους όσο και σε πειραματόζωα έχει βρεθεί ότι επηρεάζει και τις διαιτητικές προτιμήσεις, πρωτίστως της πρωτεΐνης και του υδατάνθρακα5,6. Σεροτονινεργικά φαρμακευτικά ανάλογα όπως η φενφλουραμίνη και η φλουοξετίνη, οδηγούν στη μείωση της πρόσληψης θερμίδων η οποία οφείλεται στη μικρότερη πρόσληψη και κατανάλωση υδατανθράκων ενώ η πρωτεϊνική πρόσληψη παραμένει σχετικά σταθερή19-23. Σημειώνεται πως η σεροτονινεργικού τύπου δράση αυτή, δηλαδή η συντήρηση της πρωτεϊνικής πρόσληψης και η ελάττωση της υδατανθρακικής είναι εμφανέστερη σε πειραματόζωα που υπόκεινται σε στέρηση τροφής (deprived) παρά σε ελεύθερα τρεφόμενα (free feeding)23.
H μελέτη του σεροτονινεργικού συστήματος είναι εξαιρετικά δύσκολη εξαιτίας της πολλαπλότητας και ετερογένειας των υποδοχέων της 5-ΗΤ καθώς και της έλλειψης απόλυτα εξειδικευμένων αγωνιστών και ανταγωνιστών τους14,18. Από τους 14 σεροτονινεργικούς υποδοχείς που έχουν μέχρι σήμερα ταυτοποιηθεί, οι 5-HT1B και 5-HT2C υποδοχείς εμφανίζεται να συνδέονται με τη διαδικασία κορεσμού ενώ η διέγερση των 5-HT1A αυτοϋποδοχέων αυξάνει την πρόσληψη της τροφής5,18,24-29. Ωστόσο παραμένει άγνωστος ο ακριβής ρόλος τόσο αυτών όσο και άλλων υποτύπων της 5-ΗΤ στον κορεσμό καθώς και στην επιλογή τροφής εμπλουτισμένης σε υδατάνθρακα, λίπος ή πρωτεΐνη5,29. Τα στοιχεία που διαθέτουμε μέχρι σήμερα και που προέρχονται από πειραματικά μοντέλα επιλογής τροφής είναι ιδιαίτερα αντιφατικά, τόσο στα πειραματόζωα όσο και στους ανθρώπους5,6.
Ο σκοπός μας στην παρούσα πειραματική μελέτη ήταν η διερεύνηση και η διαφοροποίηση του ρόλου των 5-HT1A και των 5-HT2C υποδοχέων τόσο στην πρόσληψη όσο και στην επιλογή της τροφής, από δύο ισοθερμιδικής αξίας δίαιτες εμπλουτισμένες σε πρωτεΐνη ή σε υδατάνθρακας αντίστοιχα. Χρησιμοποιήθηκε καταρχήν η βουσπιρόνη (buspirone), που δρα ως αγωνιστής στους 5-HT1A αυτοϋποδοχείς και διεγείρει την πρόσληψη της τροφής μέσω της αναστολής της σεροτονινεργικής δραστηριότητας στους πυρήνες της ραφής στο μεσεγκέφαλο18,19,30-32. Χορηγήθηκε επίσης η μεσουλεργίνη (mesulergine), που αποτελεί ισχυρό ανταγωνιστή των 5-HT2C υποδοχέων αλλά μη εκλεκτικό ενώ ταυτόχρονα διεγείρει και τους D2 υποδοχείς της ντοπαμίνης, έχει δε βρεθεί ότι επάγει την πρόσληψη της τροφής στα πειραματόζωα18,33-35. Χρησιμοποιήθηκε και το m-CPP (m-Clorophe-nylpiperazine), ένας μη εκλεκτικός 5-HT2C/1B αγωνιστής που εμφανίζει τουλάχιστον δεκαπλάσια εκλεκτικότητα σύνδεσης για τους 5-HT2C υποδοχείς σε σχέση με τους 5-HT1Β και έχει βρεθεί πως ελαττώνει την πρόσληψη τροφής24,36-38. Συνοπτικά με τη χρήση αυτών των φαρμακευτικών ουσιών ή και των συνδυασμών τους ο πειραματικός σχεδιασμός απέβλεπε στα εξής: Διεγείροντας τους δύο υπότυπους των σεροτονινεργικών υποδοχέων 1Α και 2C μόνους τους ή σε συνδυασμό μεταξύ τους (βουσπιρόνη, m-CPP) ή αποκλείοντας τον 2C (μεσουλεργίνη) μόνο του ή σε συνδυασμό με τη διέγερση του 1Α ή του 2C αντίστοιχα (βουσπιρόνη ή m-CPP), να μπορούμε να αποδώσουμε στον εκάστοτε υπό θεώρηση υποδοχέα κάθε μεταβολή που συμβαίνει στη διαιτητική συμπεριφορά των πειραματόζωων. Τέλος κρίθηκε αναγκαία λόγω του διπλού τρόπου δράσης της μεσουλεργίνης, η χορήγηση και ενός αμιγούς ντοπαμινεργικού αγωνιστή, της απομορφίνης (apomorphine) προκειμένου να μελετήσουμε τις πιθανές αλληλεπιδράσεις του σεροτονινεργικού συστήματος με το ντοπαμινεργικό στη συμπεριφορά πρόσληψης και επιλογής του είδους της τροφής. Η απομορφίνη διαθέτει γνωστή υποφαγική δράση39,40.
Υλικό και μέθοδος
Χρησιμοποιήθηκαν αρσενικοί επίμυες γένους Wistar, μέσης ηλικίας 2 μηνών και σωματικού βάρους 230±5g, που κατανεμήθηκαν σε 20 ομάδες (8 ζώα/ομάδα). Τα ζώα παρέμεναν σε ατομικούς κλωβούς και λάμβαναν από δύο τροφεία (Α,Β) ισοθερμιδικής αξίας Τροφή Εμπλουτισμένη σε Πρωτεΐνη (ΤΕΠ) ή Υδατάνθρακα (ΤΕΥ) αντίστοιχα, με σταθερή αναλογία λίπους όμως. Οι δύο δίαιτες παρασκευάσθηκαν στο εργαστήριό μας41,42 τα δε ακριβή ποσοστά των συστατικών τους παρουσιάζονται στον πίνακα 1.

Εφαρμόστηκε το μοντέλο κυκλικής στέρησης τροφής που συνίσταται σε εναλλαγή περιόδων σύντομης στέρησης τροφής (16 ώρες) και ελεύθερης διατροφής (32 ώρες)43. Το μοντέλο αυτό εκτιμήθηκε ως το πιο δόκιμο για την παρούσα εργασία. Πριν τη διεξαγωγή του πειράματος, τα ζώα εγκλιματίστηκαν σε 3 πλήρεις περιόδους στέρησης και επανασίτισης. Τα τροφεία εναλλάσσονταν καθημερινά προκειμένου να αποφευχθεί η ανάπτυξη επιλογής τροφής με βάση τη θέση τους.
Όλες οι φαρμακευτικές ουσίες που χρησιμοποιήθηκαν, χορηγήθηκαν ενδοπεριτοναϊκά (i.p.) την ίδια πάντα ώρα το πρωί (9:00 και 9:30 π.μ. αντίστοιχα) στις ακόλουθες εφάπαξ δόσεις:
Το δεύτερο φάρμακο ή ο φυσιολογικός ορός δίδονταν 30 λεπτά αργότερα μετά την πρώτη ένεση. Συνολικά μελετήθηκαν 20 ομάδες πειραματόζωων. Την τελευταία ημέρα του πειράματος χορηγούνταν οι υπό μελέτη ουσίες ή το έκδοχο (μάρτυρες) και μετά την πάροδο 4ώρου γινόταν η μέτρηση της προσλαμβανόμενης δίαιτας (ΤΕΠ και ΤΕΥ αντίστοιχα) και από τα δύο τροφεία Α και Β καθώς και της Ολικής Προσλαμβανόμενης Τροφής (ΟΠ). Η έναρξη του 4ώρου της μέτρησης γίνονταν 30 λεπτά μετά τη δεύτερη ένεση φαρμάκου ή φυσιολογικού ορού στα ζώα.
Τα αποτελέσματα εκφράζονται ως μέσοι όροι (ΜΟ) και τυπικά σφάλματα (±SE). Στη στατιστική ανάλυση οι αντίστοιχες συγκρίσεις πραγματοποιήθηκαν με τη βοήθεια της Ανάλυσης Μεταβλητότητας ως προς δύο παραμέτρους (Two Way Analysis of Variance, MANOVA), όπου στους "πολλαπλούς ελέγχους διακύμανσης" ("Multiple Range Tests") για τον καθορισμό των ομοιογενών ομάδων σύγκρισης επιλέχθηκε η μέθοδος Tukey HSD ως η πλέον επιφυλακτική, με επίπεδο εμπιστοσύνης 95%. To επίπεδο της στατιστικής σημαντικότητας καθορίσθηκε στο 0,05.
Aποτελέσματα
Αποτελέσματα της δράσης της βουσπιρόνης στην όρεξη και στις διαιτητικές προτιμήσεις των επιμύων
Η βουσπιρόνη και στις τέσσερις δόσεις που χορηγήθηκε, διατήρησε την πρωτεϊνική πρόσληψη (ΤΕΠ) στα επίπεδα των μαρτύρων και στις τέσσερις δόσεις που χορηγήθηκε [F(4,35)=0.914, p<1.0], ενώ αύξησε τον προσλαμβανόμενο υδατάνθρακα (ΤΕΥ) [F(4,35)=3.237, p<0.002] καθώς και τη συνολική πρόσληψη (ΟΠ) [F(4,35)=4.146, p <0.001] (Διάγραμμα 1).

Αποτελέσματα της δράσης της μεσουλεργίνης στην όρεξη και στις διαιτητικές προτιμήσεις των επιμύων
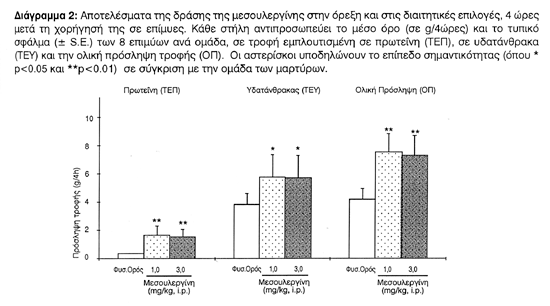
Με τη μεσουλεργίνη τα πειραματόζωα ανέπτυξαν υπερφαγία, με αύξηση της πρωτεϊνικής (ΤΕΠ) [F(2,21)=7.909, p<0.0001] όσο και της υδατανθρακικής πρόσληψης (ΤΕΥ) [F(2,21)=2.530, p<0.009] καθώς φυσικά και στη συνολική πρόσληψη τροφής (ΟΠ) [F(2,21)=5.588, p< 0.0001] (Διάγραμμα 2).
Αποτελέσματα της δράσης του m-CPP στην όρεξη και στις διαιτητικές προτιμήσεις των επιμύων
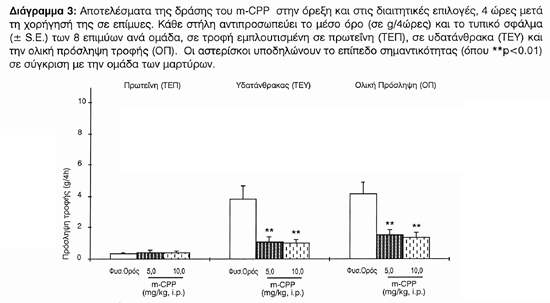
Το m-CPP συντήρησε την πρωτεϊνική πρόσληψη (ΤΕΠ) στα επίπεδα των μαρτύρων [F(2,21)=0.950, p<1.0] και μείωσε σημαντικά την υδατανθρακική (ΤΕΥ) [F(2,21)=3.904, p<0.0001] καθώς και τη συνολική πρόσληψη (ΟΠ) [F(2,21)=2.412, p<0.007]. Παρατηρήθηκε ότι το m-CPP άσκησε την αναμενόμενη σεροτονινεργικού τύπου δράση του (Διάγραμμα 3).
Αποτελέσματα της δράσης της βουσπιρόνης στην όρεξη και στις διαιτητικές προτιμήσεις των επιμύων στους οποίους αρχικά χορηγήθηκε μεσουλεργίνη
Στο συνδυασμό μεταξύ μεσουλεργίνης και βουσπιρόνης παρατηρήθηκε σημαντική αύξηση στην πρωτεϊνική (ΤΕΠ) [F(4,35)=9.869, p<0.0001], στην υδατανθρακική [F(4,35)=13.871, p<0.0001 ] και στη συνολική πρόσληψη (ΟΠ) [F(4,35)=20.091, p<0.0001] (Διάγραμμα 4). Σε σύγκριση με τις αντίστοιχες ομάδες αμιγούς μεσουλεργίνης και στις ομάδες συνδυασμού των δύο ουσιών η βουσπιρόνη τείνει να αναστρέψει τη δράση της μεσουλεργίνης όσον αφορά την πρωτεϊνική πρόσληψη. Η βουσπιρόνη επίσης στις ομάδες συνδυασμού των δύο ουσιών εμφανίζει ιδιαίτερα στις μικρές δόσεις της συνέργεια με τη μεσουλεργίνη όσον αφορά την πρόσληψη του υδατάνθρακα σε σύγκριση με τις αντίστοιχες ομάδες αμιγούς βουσπιρόνης ή μεσουλεργίνης.

Αποτελέσματα της δράσης του m-CPP στην όρεξη και στις διαιτητικές προτιμήσεις των επιμύων στους οποίους αρχικά χορηγήθηκε βουσπιρόνη
Στο συνδυασμό βουσπιρόνης και m-CPP διατηρείται η πρωτεϊνική πρόσληψη (ΤΕΠ) στα επίπεδα των μαρτύρων και της αμιγούς βουσπιρόνης [F(4,35)=1.669, p<1.0], ενώ η δράση της βουσπιρόνης στην υδατανθρακική πρόσληψη (ΤΕΥ) [F(4,35)=(4,35)=13.871, p<0.0001] όσο και στη συνολική πρόσληψη (ΟΠ) [F(4,35)=14.091, p<0.0001] αναστρέφεται από το m-CPP και έτσι έχουμε κυριαρχία της δράσης του m-CPP (Διάγραμμα 5).

Αποτελέσματα της δράσης του m-CPP στην όρεξη και στις διαιτητικές προτιμήσεις των επιμύων στους οποίους αρχικά χορηγήθηκε μεσουλεργίνη
Στο συνδυασμό μεσουλεργίνης και m-CPP, η πρωτεϊνική πρόσληψη (ΤΕΠ) αυξήθηκε σημαντικά [F(2,21)=8.904, p<0.0001], ενώ η υδατανθρακική (ΤΕΥ) [F(2,21)=1.312, p<1.0] και η συνολική πρόσληψη (ΟΠ) [F(2,21)=1.794, p<1.0] παρέμειναν αμετάβλητες (Διάγραμμα 6).

Παρατηρείται ότι σε σύγκριση με τις ομάδες του αμιγούς m-CPP, η μεσουλεργίνη στις ομάδες συνδυασμού των δύο φαρμακευτικών ουσιών εμφανίζεται αναστρέφει τη δράση του m-CPP τόσο στην πρωτεϊνική όσο και στην υδατανθρακική πρόσληψη.
Αποτελέσματα της δράσης της απομορφίνης στην όρεξη και στις διαιτητικές προτιμήσεις των επιμύων
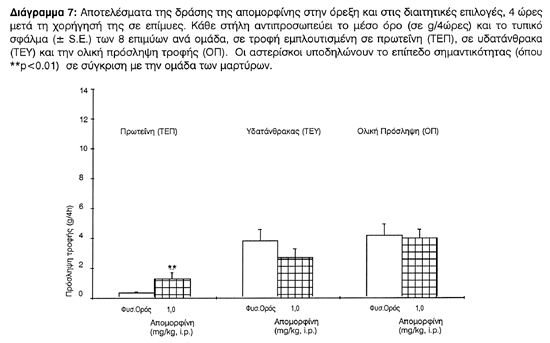
Η απομορφίνη μέσω της ντοπαμινεργικής της δράσης προκάλεσε σημαντική αύξηση στην πρωτεϊνική πρόσληψη (ΤΕΠ) [F(1,14)=4.780, p<0.0001], ενώ η υδατανθρακική πρόσληψη (ΤΕΥ) μειώθηκε [F(1,14)= 0.838, p<1,0] και η συνολική πρόσληψη παρέμεινε σχεδόν αμετάβλητη [F(1,14)=0.943, p<1,0] σε σύγκριση με την ομάδα των μαρτύρων (Διάγραμμα 7). Παρατηρείται ότι σε σύγκριση με τις ομάδες αμιγούς μεσουλεργίνης οι προσλαμβανόμενες ποσότητες πρωτεΐνης δεν διαφέρουν από την αντίστοιχη της απομορφίνης, γεγονός που σημαίνει ότι η αυξημένη πρωτεϊνική πρόσληψη που επιφέρει η μεσουλεργίνη πρέπει να σχετίζεται με τη ντοπαμινεργική της δράση, ενώ η αυξημένη υδατανθρακική πρόσληψη με την αντισεροτονινεργική της δράση αφού η ντοπαμίνη μειώνει τον υδατάνθρακα.
Η γενική παρατήρηση που απορρέει από όλα αυτά τα αποτελέσματα είναι ότι η δράση που ασκούν τα φάρμακα αυτά στην ολική προσλαμβανόμενη τροφή (ΟΠ) είναι αποτέλεσμα της επίδρασής τους στην προσλαμβανόμενη ποσότητα του υδατάνθρακα.
Συζήτηση
Πλήθος από μελέτες στις οποίες χορηγήθηκαν σεροτονινεργικά φαρμακευτικά ανάλογα είτε συστηματικά είτε απευθείας σε εγκεφαλικές περιοχές (π.χ. υποθάλαμος) σε πειραματόζωα, κατέδειξαν ότι η σεροτονίνη (5-ΗΤ) ασκεί ανασταλτικό ρόλο στη ρύθμιση της πρόσληψης της τροφής14,21,44,45. Σεροτονινεργικοί αγωνιστές όπως η d-φενφλουραμίνη και η φλουοξετίνη, οι οποίοι δρουν μέσω της ενδογενούς σεροτονίνης, οδηγούν σε μειωμένη κατανάλωση θερμίδων εξαιτίας της μειωμένης πρόσληψης υδατάνθρακα ενώ δεν επηρεάζουν σημαντικά την πρωτεϊνική πρόσληψη19-23. Η σεροτονινεργικού τύπου δράση αυτή, δηλαδή η συντήρηση της πρωτεϊνικής πρόσληψης και η ελάττωση της υδατανθρακικής είναι εμφανέστερη σε πειραματόζωα που υπόκεινται σε στέρηση τροφής παρά σε ελεύθερα τρεφόμενα23.
Έχει επαρκώς τεκμηριωθεί ότι οι 5-HT1B και 5-HT2C υπότυποι των σεροτονινεργικών υποδοχέων εμπλέκονται αποκλειστικά στην υποφαγία που επιφέρει η σεροτονίνη, σε αντίθεση με τους 5-HT1Α αυτοϋποδοχείς οι οποίοι ευθύνονται για την υπερφαγία πιθανόν μέσω της αναστολής της απελευθέρωσης σεροτονίνης από τους εγκεφαλικούς νευρώνες5,18. Παρόλο ότι υπάρχει ένας μεγάλος όγκος πειραματικών δεδομένων, δεν έχει διασαφηνιστεί πλήρως ότι κάποιος υπότυπος σεροτονινεργικού υποδοχέα ευθύνεται για την επιλογή τροφής εμπλουτισμένης σε υδατάνθρακα, λίπος ή πρωτεΐνη5,29.
Η μεσουλεργίνη, ένας σεροτονινεργικός ανταγωνιστής των 5-HT2C υποδοχέων και ταυτόχρονα ντοπαμινεργικός αγωνιστής στους D2 υποδοχείς, είναι γνωστό πως επάγει την πρόσληψη της τροφής κατά τη διάρκεια 4ωρης πειραματικής δοκιμασίας18,46. Σύμφωνα με τα αποτελέσματά μας, η μεσουλεργίνη οδηγεί σε σημαντική αύξηση στη συνολική πρόσληψη τροφής εξαιτίας της αύξησης τόσο στην πρωτεϊνική όσο και στην υδατανθρακική πρόσληψη. Η υπερφαγική αυτή απάντηση και στις δύο ισοθερμιδικής αξίας δίαιτες δεν θα μπορούσε να εξηγηθεί ως απλή αντισεροτονινεργική δραστηριότητα, καθώς γνωρίζουμε καλά ότι το σεροτονινεργικό σύστημα συντηρεί την πρωτεϊνική πρόσληψη και καταστέλλει την υδατανθρακική. Προτείνεται λοιπόν ότι η επίδραση της μεσουλεργίνης στην 4ωρη πρόσληψη τροφής είναι η έκφραση του διπλού τρόπου δράσης της- ανταγωνιστική δράση στους 5-HT2C υποδοχείς που εντοπίζονται κυρίως στο μεσοκοιλιακό υποθάλαμο και ταυτόχρονα αγωνιστική δράση στους D2 υποδοχείς που απαντώνται κυρίως στον πλάγιο υποθάλαμο28,29,33,35,47.
Η πρότασή μας αυτή βασίζεται στο γεγονός ότι η απομορφίνη, ένας γνωστός D2 αγωνιστής, αν και προκάλεσε μείωση στη συνολική πρόσληψη της τροφής, επιμέρους επέφερε σημαντική αύξηση στην πρωτεϊνική πρόσληψη. Έχει καταδειχθεί ότι η ντοπαμίνη δρα μέσω των D2 υποδοχέων προκειμένου να ανασταλεί η πρόσληψη της τροφής καθώς επίσης ότι οι υποδοχείς αυτοί έχουν συνδεθεί με την πρωτεϊνική πρόσληψη47-49. Ως εκ τούτου, είναι πιθανό ότι τόσο η πρόσληψη όσο και η επιλογή τροφής τις οποίες επιφέρει η μεσουλεργίνη εξηγούνται ως η αλληλεπίδραση μεταξύ των 5-HT2C και των D2 υποδοχέων που βρίσκονται σε γειτονικές περιοχές του υποθαλάμου. Η μεσουλεργίνη λοιπόν, οδηγεί σε πρόσληψη και επιλογή τροφής με διπλό τρόπο δράσης: αφενός αυξάνει την ΤΕΠ όπως ακριβώς η απομορφίνη ένας καθαρά ντοπαμινεργικός αγωνιστής, αφετέρου αυξάνει την ΤΕΥ ως ανταγωνιστής των 5-HT2C υποδοχέων50.
Είναι γνωστό για τη βουσπιρόνη που διεγείρει τους 5-HT1Α αυτοϋποδοχείς, ότι αυξάνει την πρόσληψη της τροφής πιθανόν μέσω της αναστολής απελευθέρωσης της σεροτονίνης από τους νευρώνες που βρίσκονται στους πυρήνες ραφής στο μεσεγκέφαλο18,26,31. Αυτού του είδους η υπερφαγία είναι εκλεκτικού τύπου, δηλαδή αφορά συγκεκριμένα θρεπτικά συστατικά. Σε επίμυες με ταυτόχρονη πρόσβαση σε δύο ειδών δίαιτες που διαφέρουν ως προς το περιεχόμενο σε πρωτεΐνη και υδατάνθρακα, η βουσπιρόνη εκλεκτικά αύξησε την πρόσληψη του υδατάνθρακα κατά τη διάρκεια της πειραματικής δοκιμασίας32,51. Τα δικά μας δεδομένα υποστηρίζουν ότι η παρέμβαση στους 5-HT1Α αυτοϋποδοχείς διαδραματίζει έμμεσο, όχι άμεσο, ρόλο στον έλεγχο της πρόσληψης και της επιλογής τροφής. Η διέγερσή τους ή ο αποκλεισμός τους μεταβάλλει τα επίπεδα της σεροτονίνης (5-ΗΤ), τα οποία με τη σειρά τους διεγείρουν άλλους υπότυπους σεροτονινεργικών υποδοχέων καταλήγοντας έτσι σε μεταβολές στην πρόσληψη και την επιλογή τροφής.
Αντιθέτως, η χορήγηση του m-CPP, ενός μη εκλεκτικού 5-HT2C/1B αγωνιστή, οφείλει να επιφέρει υποφαγία διαμέσου καθαρά δράσης σεροτονινεργικού τύπου24,37,38. Στη δική μας πειραματική μελέτη αυτό επιβεβαιώθηκε πλήρως, καθώς παρατηρήθηκε σημαντική μείωση στην υδατανθρακική πρόσληψη και καμία ουσιαστική μεταβολή στην πρωτεϊνική. Βασιζόμενοι στα αποτελέσματά μας προτείνουμε επίσης ότι οι 5-HT2C υποδοχείς παίζουν τον κυρίαρχο, αν όχι τον αποκλειστικό, ρόλο στην πρόσληψη της τροφής και στις διαιτητικές προτιμήσεις. Παρατηρήσαμε ότι η βουσπιρόνη προκάλεσε σημαντική αύξηση στην πρόσληψη του υδατάνθρακα, όταν αυτή χορηγήθηκε μόνη της. Εάν οι 5-HT1Α αυτοϋποδοχείς ήταν οι κύριοι υπεύθυνοι αυτής της δράσης, τότε η συγχορήγηση βουσπιρόνης και m-CPP θα εμφάνιζε ίδια δράση όπως έκανε η βουσπιρόνη μόνη της, δηλαδή ευόδωση της πρόσληψης συνολικής τροφής όσο και υδατάνθρακα επιμέρους. Εδώ όμως συνέβη ακριβώς το αντίθετο. Με άλλα λόγια, είχαμε δράση σεροτονινεργικού τύπου, γεγονός που συνεπάγεται πως διαμέσου της επίδρασης του οι 5-HT2C υποδοχείς υπερισχύουν των αντίστοιχων 5-HT1Α. Ανατρέχοντας στη σχετική βιβλιογραφία καταγράφεται σε μελέτες συμπεριφοράς ότι οι δράσεις που προκαλούνται είτε από την προσυναπτική είτε από τη μετασυναπτική διέγερση των 5-HT1Α υποδοχέων, αντιστρέφονται σε σημαντικό βαθμό από την ενεργοποίηση των 5-HT2C μετασυναπτικών υποδοχέων52,53. Φυσικά δεν μπορούμε να αποκλείσουμε την έμμεση συμβολή των 5-HT1Α αυτοϋποδοχέων όσον αφορά την πρόσληψη της τροφής και στις διαιτητικές προτιμήσεις. Σημειώνεται ότι η συγχορήγηση της μεσουλεργίνης και της βουσπιρόνης προκάλεσε σημαντική υπερφαγία, η οποία αποδίδεται πρωτίστως στη σημαντική κατανάλωση του υδατάνθρακα. Μάλιστα ήταν σχεδόν η διπλάσια συγκρινόμενη με την κατανάλωση που προκάλεσε η καθεμία από τις δύο φαρμακευτικές ουσίες μόνη της. Διαπιστώνεται λοιπόν συνεργική δράση των δύο φαρμάκων.
Συνοπτικά στην παρούσα πειραματική μελέτη καταδεικνύεται ότι η μεσουλεργίνη, ένας ανταγωνιστής των 5-HT2C υποδοχέων και ταυτόχρονα αγωνιστής των D2 υποδοχέων, οδηγεί σε πρόσληψη και επιλογή τροφής μέσω διπλού τρόπου δράσης: εξαιτίας της ταυτόχρονης αντισεροτονινεργικής και ντοπαμινεργικής δραστηριότητας προκαλεί υπερφαγία που βαδίζει παράλληλα με αύξηση τόσο στην πρωτεϊνική πρόσληψη (δράση απομορφίνης) όσο και στην υδατανθρακική (αντισεροτονινεργική δράση) αντίστοιχα. Η βουσπιρόνη λόγω της δράσης της στους 5-HT1Α αυτοϋποδοχείς μοιάζει να επηρεάζει έμμεσα τις διαιτητικές προτιμήσεις. Ο αποκλεισμός των 5-HT2C μετασυναπτικών υποδοχέων αποτελεί τον πιο σημαντικό λόγο για την αύξηση της υδατανθρακικής πρόσληψης, σε αντίθεση με την αναστολή απελευθέρωσης της σεροτονίνης από τους 5-HT1Α αυτοϋποδοχείς. Τα παραπάνω δεδομένα συνηγορούν υπέρ της άποψης ότι οι υποθαλαμικοί 5-HT2C υποδοχείς διαδραματίζουν τον κυρίαρχο ρόλο στις ανορεκτικές ιδιότητες της σεροτονίνης. Φαίνεται ότι η οποιαδήποτε παρέμβαση στους 5-HT1Α αυτοϋποδοχείς "διοχετεύεται" στους 5-HT2C μετασυναπτικούς υποδοχείς, οι οποίοι άμεσα αν όχι αποκλειστικά εμπλέκονται στην προκαλούμενη από τη σεροτονίνη (5-ΗΤ) καταστολή της συνολικής πρόσληψης τροφής και επιμέρους του υδατάνθρακα.
Στον άνθρωπο, τόσο σε προ-κλινικές όσο και κλινικές μελέτες προκύπτει πως οι 5-HT2C υποδοχείς μέσα από τη χορήγηση της d-φενφλουραμίνης που αποτελεί έναν μη εκλεκτικό αγωνιστή τους, είναι οι κύριοι υπεύθυνοι για την ανορεκτική δράση της15,16. Καθώς οι συγκεκριμένοι υποδοχείς εμφανώς απουσιάζουν από την περιφέρεια και ως εκ τούτου η ενεργοποίηση τους είναι μάλλον απίθανο να ευθύνεται για την καρδιοτοξικότητα και την πρωτοπαθή πνευμονική υπέρταση οι οποίες συνδέονται με τη χορήγηση της d-φενφλουραμίνης16,28,29,54. Συνάγεται λοιπόν ότι η διέγερση των 5-HT2C υποδοχέων από τη χορήγηση όμως ενός εκλεκτικού αγωνιστή, αντιπροσωπεύει τη δυνατότητα για ανάπτυξη ασφαλούς και αποτελεσματικού φαρμακευτικού σκευάσματος κατά της υπερβολικής πρόσληψης τροφής.
Οι διαταραχές πρόσληψης τροφής έχουν αποτελέσει ένα από τα σύγχρονα πεδία έρευνας της Φαρμακολογίας, ιδίως μετά τη διαπίστωση ότι η βουλιμία και οι λαίμαργες απαιτήσεις για κατανάλωση υδατανθράκων ή εύγευστης γενικότερα τροφής παρατηρούνται συχνά στους ασθενείς αυτούς1,2,55. Τα ευρήματα αυτά διευρύνουν το πεδίο κατανόησής μας στο νευροβιολογικό υπόστρωμα της όρεξης και των διαταραχών πρόσληψης τροφής και συμβάλλουν σε πειραματικές μελέτες που αφορούν νέα φάρμακα εναντίον της υπερφαγίας και της παχυσαρκίας, ειδικά σε εκείνες τις ουσίες με 5-HT2C αγωνιστικές ιδιότητες38,56,57.
ΒΙΒΛΙΟΓΡΑΦΙΑ